УДК:796.015.6:616.74
О. В. Гузій, І. М. Башкін, В. П. Корж
БІОХІМІЧНІ АСПЕКТИ УШКОДЖЕННЯ
СКЕЛЕТНИХ М'ЯЗІВ
ПРИ ІНТЕНСИВНИХ ФІЗИЧНИХ НАВАНТАЖЕННЯХ
Йдеться
про те, що тривалі субмаксимальні
навантаження на біговій доріжці викликають дефіцит у м'язах макроергічних
фосфатів, а саме: зниження вмісту КФ і АТФ, і збільшення АДФ. Різко підвищують
проникливість біологічних мембран за рахунок структурних переходів у білках і
ліпідах, активізують процеси вільно-радикального окиснення (ВРО). Відбулося зниження
в уражених тканинах активності ферменту Na+/K+-АТФази, а
також підвищення активності лізосомальних протеолітичних ферментів-катехинів В
і Д. Активуються протеолітичні ферменти, що у свою чергу призводить до
генералізації та маніфестації процесів ушкодження клітин скелетних м’язів.
Ключові слова:
фізичне навантаження, м'яз, ферменти, активність, тканина.
Постановка
проблеми. Сучасний спорт неухильно наближається до екстремальних видів людської
діяльності з|із| постійно зростаючими фізичними і психічними навантаженнями.
Коли фізичні навантаження (ФН) здійснюються на межі адаптивних можливостей
організму, вони можуть викликати негативні зміни структурного та
функціонального статусів скелетних м'язів [1,2,4,6].
Розглянута
проблема має теоретичний і практичний інтерес, тому що більш детальне розуміння
механізмів, що лежать в основі зниження функції м'язів при їх посиленому
функціонуванні, може допомогти зменшити пошкодження і прискорити відновлення
м'язової тканини.
Аналіз
останніх досліджень і публікацій.
Пошкодження скелетних м'язів,
індуковані ФН, призводять як до локальних, так і до системних порушень [7]. При
ФН не відбувається втрати м'язової маси, як, наприклад, при гіподинамії й
гіпогравітації, однак унаслідок дуже високих і тривалих навантажень, що
виконуються м'язами, виникають пошкодження м'язових волокон, механізм
реалізації яких включає як біохімічні, так і імунологічні реакції [10]. Крайнім
випадком у загальному ланцюгу ушкоджень є розрив самого м'яза (зв'язки) [8].
Ушкодження можуть відновлюватися за рахунок власних регенеративних можливостей
м'язової тканини, або потребують терапевтичного, а часом і хірургічного
втручання.
Мета дослідження: дослідити зміни в м'язах, які відбуваються
при ФН, та визначити результат, до якого призводять дані зміни.
Методи і організація
досліджень. Проведено модельні експерименти із використанням стандартного
тесту (біг на тредмилі до повного виснаження, 32 м/хв., та повторно через 1 годину
20м/хв., нахил 7,5 %) на 32 білих щурах|пацюках| лінії Вістар. Всі маніпуляції
було виконано в повній відповідності щодо положень про догляд за тваринами і
використання їх з експериментальними цілями, прийнятими в Європейському
Союзі.
Після експериментального
тестування тварини виводилися із експерименту,
відповідно до загальновизначених правил, одразу після проведення тесту на 1-3
день після тестування. У безбілковому перхлорному екстракті тканин скелетної мускулатури,
визначали вміст, а саме: аденілових нуклеотидів (Н.Б. Захаров и др., 1980),
креатин фосфату (А.М. Алексеева, 1951), глікогену (Good, 1933), лактату
(Hohorst, 1962), пірувату (Zock, Lampreht, 1962). Методом диференційованого
центрифугування у гомогенізатах тканин у сольовому ізотонічному середовищі
виділяли цитоплазматичну фракцію і мембрани клітин, де визначали активність:
фосфофруктокінази (Г.А.Кочетов, 1980); мієлопероксидази (М.З. Саидов, Б.В.
Пинегин, 1998); Na+/K+-АТФази (А.М. Казеннов,1984);
катепсину D (Дж. Дингл, 1980) й катепсину В (A. J.Barrett,1981); ферментів
антирадикального і антиперекисного захисту – супероксиддисму-тази (СОД) (Е.Е.
Дубинина, 1983), глутатіонпероксидази (ГПО) (В.И. Моин, 1986) і каталази (М. А.
Королюк и др., 1988), вміст кінцевих продуктів реакцій перекисного окиснення
ліпідів, що реагують із тіобарбитуровою кислотою (малонового діальдегіду) (И.Д.
Стальная, 1977).
Математичну
та статистичну обробку результатів досліджень проводили із використанням
програмних пакетів GrafPadPrism 4.0 (GrafPadSowtwareInc., США) та Exсel 2003
(Microsoft Corp., США).
Результати дослідження та
їх обговорення. Уважають,
що при дозованих ФН м'язи здорової людини не піддаються ішемії – приплив крові
до них достатній. Разом з тим, високо інтенсивні ФН викликають сильну
метаболічну гіпоксію м'язів, наслідки якої після припинення навантаження
виявляються схожими з наслідками реперфузії при ішемії [3]. Надмірні ФН
викликають суттєві метаболічні та функціональні зміни в організмі, наслідком
яких є відмовлення від подальшого виконання роботи.
Результати, отримані нами при
обстеженні щурів, до яких були застосовані тривалі субмаксимальні навантаження
на біговій доріжці, підтверджують дані Kuipers H. et al. (1983) [9], що під
впливом ФН у м'язовій тканині виникають дегенеративні вогнища. Особлива
виразність наданого процесу була у тих м'язах, які безпосередньо залучені у
бігові навантаження, у нашому випадку m. soleus, m. Rectusfemoris та m.
vastuslateralis. Негативні зміни мали місце по закінченню рекомендованих
навантажень, та у різній степені виразності проявлялися на 1-3 дні
експерименту.
Перш за все, рекомендоване ФН
викликало дефіцит у м'язах макроергічних фосфатів, які утворюються у сполучених
із окиснювально-відновними процесами реакціях фосфорилювання на внутрішній мембрані
мітохондрій, на підтвердження чого було зниження вмісту КФ і АТФ і збільшення
АДФ (рис. 1).
При цьому, процеси ресинтезу
АТФ у мітохондріях тісно пов'язані не тільки з окиснювально-відновними
реакціями, а й з реакціями гліколізу, ліполізу, протеолізу, які є
постачальниками Ацетил- КоА для циклу Кребса.
У
регуляції шляхів субстратної трансформації глюкози беруть участь багато
ферментів: фосфорилаза, гексокіназа, фосфофруктокіназа (ФФК), піруваткіназа.
ФФК відіграє роль одного з
головних регуляторних ферментів у послідовних реакціях гліколізу, активність якого інгібують АТФ та цитрат і стимулюють АМФ та
АДФ. У задіяних скелетних м'язах відразу після навантаження відзначалася
активація ключового ферменту гліколізу – ФФК з подальшим пригнічення його
активності яке відзначалося на першій добі експерименту. При цьому, на всі
терміни обстеження у м'язових тканинах, які були досліджені, спостерігалося
різке зниження запасів глікогену і накопичення продуктів гліколітичних реакцій
- молочної та піровиноградної кислоти (див. рис. 1). Дана спрямованість метаболізму
призводить до блокування процесів окиснення жирних кислот, надмірного
накопичення в тканинах кислих продуктів, формування метаболічного ацидозу.
Надмірне накопичення іонів
водню, біологічно активних сполук призводить до серйозних пошкоджень
структурних утворень клітин, різкого збільшення проникності біологічних мембран
за рахунок структурних переходів у білках і ліпідах, і активації процесів вільно-радикального
окиснення (ВРО). Щодо активації реакцій ВРО свідчили динамічні зміни активності
ферментів антирадикального і антиперекисного захисту, та підвищення вмісту
кінцевих продуктів реакцій перекисного окиснення ліпідів, що реагують із тіобарбитуровою
кислотою (табл. 1).
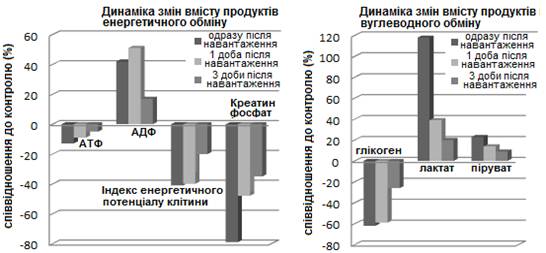
Рис. 1 Динаміка змін продуктів
вуглеводно-енергетичного обміну в м’язах після ФН
Таблиця 1
Динаміка змін окремих
показників реакцій ВРО у тканинах скелетної мускулатури у щурів на різні строки
після тестування на біговій доріжці (М±m, N тварин у групі = 8)
|
Показники
|
Контрольна
група
|
Час після фізичного навантаження
|
|
Одразу по закінченню
тестування
|
1 доба по закінченню
тестування
|
3 доби по закінченню
тестування
|
|
Активність:
|
|
СОД
|
131,54±5,01
|
87,63±6,82*
|
99,85±6,52*
|
122,12±5,87
|
|
ГПО
|
12,14±1,47
|
7,54±1,36*
|
9,67±0,89*
|
10,74±0,94
|
|
Каталаза
|
47,7±0,84
|
31,9±0,67*
|
33,4±0,92*
|
41,4±1,07*
|
|
Вміст МДА
|
0,985±0,061
|
1,810±0,075*
|
1,580±0,092*
|
1,457±0,082*
|
Прим. * - Р ≤ 0,05
Активація реакцій ВРО зачіпає
найважливіші фізико-хімічні| властивості мембран — проникність, в'язкість,
фазовий стан. Серйозну негативну дію надають виявляють механічне (осмотичне)
розтягування мембрани, адсорбція на ліпідному шарі поліелектролітів|, включаючи
деякі білки і пептиди.
Стійке
зниження в уражених тканинах активності ферменту локалізованого у мембранах
клітин, який бере участь в активному транспорті іонів – Na+/K+-АТФази,
а також підвищення активності лізосомальних протеолітичних ферментів –
катепсинів B і D, що підтверджує про наявність деструкції м'язових клітин (рис.
2).
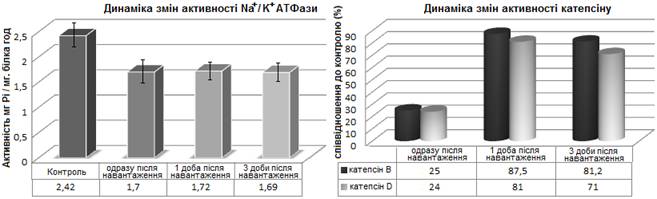
Рис. 2 Динаміка змін активності окремих
ферментів у м’язах після ФН.
Пошкодження плазмолеми
призводить до витікання екстрацелюлярних м'язових білків, розгортання запальної
реакції за участю лейкоцитів, відповіді гострої фази.
До першої доби експерименту у
м'язах тварин збільшувалася активність маркерного ферменту нейтрофілів –
мієлопероксидази (білок, що реалізується у ході дегрануляції нейтрофілів і
моноцитів), що свідчило про розвиток процесу лейкоцитарної інфільтрації, активність
якого залежала від відмінностей у ступені пошкодження волокон, які по-різному
залучені до виконання рекомендованого ФН.
Вважають, що інтенсивність
нейтрофільної інфільтрації м'язів, що супроводжує розвиток запального процесу,
є неоднаковою у волокнах різного типу [5]. Так активність мієлопероксидази в
щурів у білих, гліколітичних волокнах була нижчою порівняно з червоними,
оксидативними волокнами, де щільність капілярів значно вища, ніж у білих
волокнах [11]. На тлі активації катаболічних процесів на 1 добу експерименту
спостерігалося зниження кількості лейкоцитів та їх функціональних показників.
Набуті зміни залишалися на 3 добу експерименту.
Висновки. Картину ушкодження м'язової тканини, що
розвивається внаслідок поєднаної дії на м'яз механічного та метаболічного стресів,
ймовірно, можна представити таким чином: у динаміці розвиток дегенеративних
процесів у м’язах ініціює механічна фаза ушкодження,
яка призводить до суттєвих порушень обміну речовин у вогнищі ушкодження;
недостатність кисню до наявних потреб м'язових клітин у процесі навантаження,
призводить до накопичення кислих метаболітів та закиснення саркоплазми;
накопичення у вогнищі ушкодження біологічно активних сполук, судинна
ендотеліальна дисфункція з розбалансуванням продукції вазоконстрикторів та
вазодилятаторів, каліемія, тощо, викликають звуження кровоносних судин та
відповідно посилюють стан гіпоксії; енергетичні ресурси тканини виснажуються;
активуються протеолітичні ферменти, що, у свою чергу, призводить до генералізації
та маніфестації процесів ушкодження клітин скелетних м’язів за різними
сценаріями (некроз, апоптоз, аутоліз), зменшенню функціонально активної
тканини.
Подальші
дослідження будуть спрямовані на більш детальне вивчення особливостей розвитку змін м’язової тканини під
впливом ФН в умовах інтенсивних та тривалих тренувально-змагальних навантаженнях.
1. Башкин И.Н. Биохимические изменения в
органах и тканях лабораторных животных при истощающих физических нагрузках и
возможные пути их коррекции [Текст] / И.Н. Башкин // Наука в современном
спорте. – 2006. – № 2. – С. 49 – 55.
2. Корж
В.П. Медико-біологічне
забезпечення спортсменів вищої кваліфікації: дис. докт. мед. наук: 14.03.04. / Віктор Петрович Корж; ДДМА – Дніпропетровськ, 2010. – 16
с.
3. Морозов В.И. Морфологические и биохимические
аспекты повреждения и регенерации скелетных мышц при физических нагрузках и
гиподинамии / В.И. Морозов, Г.А.
Сакута, М.И. Калинский // Морфология. – 2006. – 129(3). – С.
88-96.
4. Тишкин В.С. Коррекция гипоксических нарушений
метаболизма вызываемых физической нагрузкой
/ В.С. Тишкин, В.В. Дунаев, И.М. Белай и др. // Фармакологическая коррекция гипоксических состояний: Тез.
докл. 1 Всесоюзн. конф., Москва, 27 – 28 января 1989 г. – Ижевск, 1989. – С. 124-125.
5. Цыпленков П.В. Влияние мышечной деятельности
на содержание миелопероксидазы в крови и скелетных мышцах крыс : Автореф.
дисс. канд. биол. наук. / П.В.
Цыпленков. – Л., 1988. – 21 с.
6. Byrne C.
Neuromuscular function after exercise-induced muscle damage: theoretical and
applied implications / C. Byrne, C. Twist, R. Eston // Sports Med. – 2004. – V.
34. – P. 49-69.
7. Evans W. J. The
metabolic effects of exercise-induced muscle damage. /W.J. Evans, J.G. Cannon
// Exerc. Sports Sci. Rev. – 1991. – V. 19. – P. 99-125.
8. Hagerman F.
Muscle fiber necrosis in marathon runners. Med. / F. Hagerman, R. Hikada,
R.Staron // Sci. Sports Exerc. – 1983. – V. 15. – Р. 164-167.
9. Kuipers H. Muscledegenerationafterexerciseinrats.
/ H.Kuipers, J. Drukker, P.M. Frederik, P. Geurten, G. vanKranenburg // Int. J.
SportsMed. – 1983. - V. 4. - P. 45-51.72.
10. Lieber R.L.
Muscle cytoskeletal disruption occurs within the first 15 min of cyclic
eccentric contraction. /R.L. Lieber, L.E. Thornell, J. J. Friden// Appl.
Physiol. - 1996. - V. 80. - Р. 278-284.
11. MacAllister R.M. Skeletal muscle fiber types and their vascular support. / R.M.
MacAllister, J.F. Amann, M.H. Laughlin // J. Reconstr. Microsurg. - 1993. - V.
9. – P. 313-317.
Подано до редакції 16.03.12
_____________

